La
cadena de transporte electrónico en el proceso respiratorio
En el tercer nivel del proceso de respiración celular
encontramos la cadena de transporte electrónico de la mitocondria.
Las coenzimas
reducidas (NADH y FADH2) generadas a lo largo de la glucólisis y de los niveles 1 y 2 de la respiración celular han de
volver
a su estado oxidado.
Ceden sus electrones a diferentes complejos multiproteicos localizados en la membrana interna de la mitocondria.
Estos complejos generan un flujo de electrones exergónico que desemboca en el O2 (aceptor final de
la cadena), que
se reduce a H2O.
Este flujo electrónico exergónico se aprovecha para generar un gradiente de H+ a través de
la membrana interna de la mitocondria.
La “resolución” del gradiente de H+ se acopla al proceso de síntesis de ATP a partir de
ADP y Pi en el proceso
de fosforilación
oxidativa.
La mitocondria
La mitocondria es un orgánulo
especializado, dedicado, no solo, a procesos de respiración
celular que conllevan la generación de energía (procesos catabólicos, anabólicos…).
Dividido
en
4
subregiones:
membrana externa, espacio intermembrana,
membrana
interna y matriz mitocondrial. La membrana
interna destaca por la formación
de las
denominadas crestas mitocondriales.
El número de mitocondrias presentes en una célula es variable y dependerá de los requerimientos energé5cos de ésta.
En la membrana interna se encuentran aquellos complejos multiproteicos que constituyen
la cadena de transporte electrónico o respiratorio de la mitocondria.
Son 5 complejos: I, II, III, IV
y V.
*Los electrones van del NADH al complejo Q directamente
La cadena respiratoria
Oxidación y
generación de energía
De manera análoga a cómo sucede en las reacciones
ácido-‐base, una reacción rédox está constituida por un agente donador de electrones
(compuesto reducido) y su aceptor
de electrones “conjugado” (compuesto oxidado).
Fe2+ à Fe3+ + 1e Fe2+ es el reductor, se oxida
Cu2+ + 1e à Cu+ Cu2+ es el oxidante, se reduce
Los electrones no se encuentran “libres” en
disolución; se requiere
en toda reacción rédox dos agentes: el donador de electrones
(compuesto
reductor)
y
el
aceptor
de
electrones (compuesto oxidante).
La tendencia
de un compuesto a reducirse
aceptando electrones se mide por el Potencial de Reducción o E y se mide en voltios (V).
El Potencial
de reducción estándar o Eo se denomina
como el potencial de reducción cuando la concentración de reductor
y su oxidante “conjugado” es 1M, a 25ºC. Por convenio el Eo del Hidrógeno es 0,00V
y el resto de potenciales de reducción
se
determinan
por
comparación
con
el
del
Hidrógeno.
Un valor negativo de potencial de reducción
implica que el compuesto 5ene poca tendencia a reducirse y, por tanto, tiende a actuar más bien como reductor,
cediendo electrones y oxidándose él.
Un valor positivo de potencial de reducción
implica que el compuesto tiene mucha tendencia a reducirse y, por tanto, tiende
a actuar como oxidante,
captando electrones.
El potencial de reducción estándar
y a condiciones de pH
7 se
expresa como Eo´.
Abajo están
los que tienden a estar más reducidos. El O2 es el aceptor final de electrones.
El NADH tiende siempre a oxidarse, a formar NAD+ pero el FADH2 tiene menos
tendencia que el NADH y por eso el NADH impulsa la síntesis de más ATP que el
FADH2
NAD+ +
H+ à NADH E=
-0.32V
½ O2 +
2H+ à H2O E=
0,82V
NADH à NAD+ + H+ E= 0,32V
Los
cambios energéticos asociados
a un proceso rédox vienen
determinados por...
Los procesos fisiológicos, incluyendo los rédox, no
tienen lugar en condiciones estándar; así, las
condiciones celulares son variables según diversos factores.
Los potenciales de reducción en condiciones no estándar se miden por la ecuación
de Nernst.
Transporte electrónico
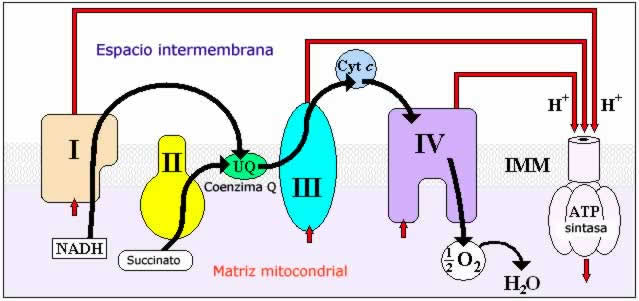
1) NADH y Complejo
I – NADH Deshidrogenasa o NADH-CoQ Oxidorreductasa.
La gran mayoría del NADH que se genera
a través de las diversas
enzimas que catalizan oxidaciones se reoxida en el complejo
I, NADH deshidrogenasa.
El complejo
NADH
deshidrogenasa
está
constituido
por
unas
25
cadenas
polipeptídicas distintas.
Este complejo
posee varias moléculas
de mononucleótido de flavina (FMN)
que se encargan de recibir los electrones procedentes del NADH:
Hay una cesión de 2 electrones entre el NADH y el FMN.
El complejo,
además, se asocia a varios grupo Fe-‐S (Fe no hemo): Fe2S2 y Fe4S4. El Fe capta o cede un
electrón cada vez.
Los electrones recogidos
por el FMN son cedidos
a los centros de Fe-S,
que los cederán
siguiente elemento de la
cadena de transporte: la coenzima Q.
El
complejo también recibe el nombre de NADH-‐coenzima
Q reductasa.
2) FADH2 y
Complejo II-‐Succinato
Deshidrogenasa o Succinato-‐CoQ Oxidorreductasa.
La propia succinato deshidrogenasa
constituye
el
complejo
II
de
la
cadena
respiratoria
mitocondrial. Está constituida
por
4
cadenas
polipeptídicas
y
emplea
como
coenzima
el
FAD,
unido
covaléntemente al enzima. Además, posee 1 centro Fe4S4, 1 centro Fe3S4, 1 centro Fe2S2 y
un citocromo b (b560).
Los
electrones del FADH2 son cedidos a los centros Fe-‐S y de ahí pasan al citocromo b560.
El citocromo b560 posee un grupo hemo idéntico
al de la hemoglobina y mioglobina: la protoporfirina IX se asocia a
un átomo de Fe (Fe hemo).
Al igual que sucede con el complejo I, los electrones del complejo II se ceden a la coenzima
Q.
La succinato deshidrogenasa también
se denomina succinato-‐coenzima
Q oxido‐reductasa.
3) Coenzima Q.
La coenzima Q no es una proteína
si no un compuesto de naturaleza lipídica.
Gracias a dicho carácter lipídico,
la coenzima Q puede trasladarse libremente por el interior de la membrana interna de la mitocondria, recogiendo electrones
de los complejos I y II para cederlos al complejo III.
También denominada ubiquinona,
capta y cede 2 electrones.
Los electrones
que vienen del NADH y que han sido captados por la coenzima Q, son
cedidos al complejo III.
4) Complejo III – Citocromo bc1 o
CoQ-‐citocromo c Oxidorreductasa:
Está constituido por 9-‐10 cadenas
polipeptidicas.
Posee 3 citocromos (b562, b566,
c1) y 1 centro Fe2S2.
Los 3 citocromos son similares al citocromo b560 y, por tanto, cada uno de ellos posee un Fe hemo.
Los electrones
fluyen en el siguiente orden: b562, b566,
Fe2S2 y
c1.
5) Citocromo c:
Se trata de una
pequeña proteína (13 kDa)
que posee un grupo hemo similar
al de los citocromos b y c1.
Recoge los
electrones del complejo
III y los cede al complejo IV.
6) Complejo
IV-‐Citocromo c oxidasa:
Constituye el complejo
IV y está formado
por 13 cadenas polipepgdicas.
Posee dos citocromos: a y a3. Estos citocromos poseen unos grupos
hemos diferentes a los
que se encuentran en los citocromos b, c y c1: grupo hemo A.
Además se asocian
a varios átomos de Cu que
también participan en el
transporte de electrones (Cu+/Cu2+).
El objetivo
final es ceder 4 electrones al O2 para que se reduzca
a 2 moléculas de H2O (aceptor final de electrones).
Este transporte de electrones constituye un proceso exergónico.
La energía liberada se emplea
para
bombear
H+ contra gradiente desde
la
matriz
mitocondrial hacia el espacio intermembrana. Concretamente, en 3 puntos de la cadena de transporte.
Fosforilación
oxidativa

Es el complejo V o ATP sintasa el encargado
de sintetizar ATP a partir de ADP y Pi aprovechando la energía que se libera al dispersarse el gradiente de H+ generado.
El complejo está constituido por más de 12 cadenas polipepgdicas y posee una región
transmembrana denominada F0 y una región en la matriz mitocondrial denominada F1. Así, el
complejo funcional se denomina F0F1.
· F1 consta de 5 proteínas
α, β, γ, δ
y ε con
una estequiometría de α3β3γδε.
· F0 consta de 3 proteínas
a, b y c con estequiometría ab2c12.
F0 se encargaría de disipar el gradiente de H+, permitiendo que estos regresen
a la matriz mitocondrial, mientras que F1 se encargaría de sintetiza el ATP a partir de ADP y Pi,
aprovechando la energía transmitida a F0 al disipar ésta el gradiente
de H+.
Hipótesis quimiosmótica
de
Peter Mitchell.
La energía que antes era de
transferencia de protones se transforma en energía cinética.
Asociado a las 12 cadenas de C, está
épsilon, por lo que está girando. A su vez, gamma está asociada a épsilon.
Gamma es la que se asocia a alfa y beta que forman 3 dímeros alfa-beta (cada
alfa y beta son como los gajos de una mandarina). Por cada F1 hay 3 dímeros alfa-beta
por lo que por cada F1 se esta sintetizando 3 ATP.
Estados estructurales: Open, laxo y
compact. Cada dímero alfa beta se encuentra en un estado estructural de los
otros dos, por lo que uno estará en open, otro en laxo y otro en compacto. Van cambiando su estructura en el orden
citado: abierto à laxo à compacto. Cambian su estructura gracias a la subunidad gamma, que
tiene una estructura asimétrica.
Los protones al pasar por el estado
intermembrana hacen girar las subunidades c, que hace que gire épsilon que
desplaza gamma y que hace que interaccione con cada uno de los dímeros.
En función del estado estructural de
cada dímero está en un momento de la síntesis de ATP.
Entra en estado abierto con baja
afinidad y pasa a estado laxo con una mayor afinidad. Cuando vuelve a girar la
subunidad gamma pasa a estado compacto donde se produce la formación de ATP. La
conformación del estado compacto hace que se produzca como de manera espontánea
al forzar el enlace fosfanhídrido. Sin embargo no puede salir pero cuando gire
al abierto, el ATP tiene baja afinidad por el dímero y sale dejando un hueco en
el dímero para volver a empezar.
¿Cómo funciona
la ATP sintasa?
El proceso de síntesis
de ATP tiene lugar en 2 fases:
1) Translocación de H+ llevada a cabo
por F0.
2) Formación del enlace
fosfoanhídrido entre el ADP y el Pi llevado a cabo
por F1.
La interacción entre F0 y F1 permitirá acoplar la disipación del gradiente de H+ a la síntesis de ATP.
Con respecto a F1, el lugar de síntesis del ATP lo cons5tuyen dímeros
de α y β (αβ). 3
dímeros αβ-3 si5os de síntesis de ATP.
Cada dímero pasa por 3 estados
conformacionales dis5ntos de manera consecu5va: laxo (L),
compacto (T) y abierto (O).
En un mismo instante,
un dímero se encuentra en forma L, otro en forma T y el tercero en forma
O.
Es la
subunidad γ la encargada de generar los cambios conformacionales.
La subunidad γ lleva a cabo rotaciones de 120o de tal manera que con cada giro provoca un
cambio estructural ordenado
en los 3 dímeros
αβ.
Según el estado conformacional en el que se encuentre
cada dímero, se unirá con mayor o menor afinidad
al ADP, al Pi y al ATP.
En
el estado T, la síntesis de ATP a partir
de ADP y Pi es espontánea. Es la liberación de la ATP
sintasa
del ATP recién formado la que requiere energía.
La
energía es aportada por el flujo
de H+.
Al ser bombeados los H+ por la F0, éstos provocan un movimiento
de rotación de las subunidades c.
La subunidad
γ de F1 se asocia a las subunidades c de F0 y cuando las segundas rotan, la
primera lo hace con ellas.
Al rotar la subunidad
γ provoca un cambio conformacional en el dímero αβ que se encontraba en forma
T y retenía unido el ATP. El dímero pasa a estado O en el que se reduce la afinidad por el ATP, lo cual
permite que se libere del complejo.
En el estado O, se unen ADP y Pi pero para que éstos se unan con alta afinidad,
el dímero ha de pasar a un estado L. Finalmente,
al pasar del estado L al estado T se vuelve a producir de manera
espontánea la síntesis
de ATP por medio de la formación del enlace anhídrido
correspondiente entre el ADP y el Pi.
En consecuencia, hay una “transmisión” de la energía liberada al disiparse el flujo de H+, de tal forma que el flujo de dicha energía
va desde la rotación de las subunidades c de F0-‐ rotación
de la subunidad γ de F1-‐cambio
conformacional de los dímeros αβ.
Lanzaderas NADH
¿Cómo se transportan desde
el citosol las moléculas de NADH que se han generado en procesos como la glucólisis?
La membrana
mitocondrial externa es permeable al paso del NADH; sin embargo,
la membrana mitocondrial interna es impermeable a esta coenzima y no existe transportador
de membrana alguno que permita
su translocación física.
Por tanto,
los equivalentes reductores
han de transportarse al interior
mitocondrial sin que haya
un movimiento físico
de la coenzima.
Se emplean
sistemas lanzadera:
· dihidroxiacetona fosfato/glicerol-‐3-‐fosfato
· malato/aspartato.
1) Sistema dihidroxiacetona fosfato/glicerol-‐3-‐fosfato: Muy activo en el cerebro.
La glicerol-‐3-‐fosfato deshidrogenasa citosólica se encarga
de
reducir
una
molécula
de
dihidroxiacetona fosfato a glicerol-‐3-‐fosfato
por medio de la oxidación
de una molécula de NADH.
El glicerol-‐3-‐fosfato
pasa al espacio intermembrana
de la mitocondria y una vez allí, la
flavoproteína deshidrogenasa (ubicada
en la membrana interna) se encarga
de reoxidarlo a dihidroxiacetona fosfato por medio de la
reducción de una molécula de FAD+ a
FADH2.
La dihidroxiacetona fosfato vuelve al citosol y el FADH2 cede sus electrones
a la coenzima Q directamente.
Este sistema genera
un descenso en la síntesis de ATP.
La membrana mitocondrial interna
usa FAD como grupo prostético.
Este proceso se da en el cerebro
y en el músculo
*En el cerebro se generan 36 y no
38 ATP
2) Sistema malato/aspartato:
Este sistema
emplea
un
par
de
transportadores
también
localizados
en
la
membrana
mitocondrial interna.
1) El oxalacetato es reducido por una malato deshidrogenasa citosólica a malato oxidando
una molécula de NADH a
NAD+.
2) El malato citosólico atraviesa la
membrana mitocondrial interna por medio de un transportador de membrana que lleva a cabo
un antiporte entre el malato y α-‐cetoglutarato.
3) El
malato, una vez en el interior de la mitocondria, se reoxida a oxalacetato por la malato deshidrogenasa mitocondrial, reduciendo una molécula de NAD+ a NADH.
4)
Por
medio de la aspartato aminotransferasa, el oxalacetato sufre una reacción de
transaminación con el Glutamato para originar Asp y cetoglutarato
El α-‐cetoglutarato se devuelve al citosol siguiendo el mecanismo
de transporte antes
citado.
El Asp sale al citosol por medio de otro transportador de membrana que lleva a cabo un antiporte entre el Asp (que se libera al citosol) y el Glu (que se internaliza a la mitocondria).
En el citosol,
la aspartato aminotransferasa citosólica regenera el oxalacetato por medio de una transaminación entre el α-‐cetoglutarato y el Asp.
Característico del hígado,
del riñón y del corazón.
No hay pérdida
del rendimiento en la
síntesis del ATP.
*No hay transportador de
oxalacetato en la membrana interna para volverlo a transportar y repetir el
ciclo. Hay unas aspartato aminotransferasa que lo saca cambiándolo a aspártico
con el alfa cetoglutarato que se ha transformado en glutámico. Ese glutámico
también hay que meterlo para seguir haciendo la transaminación
No hay comentarios:
Publicar un comentario