Dos son las principales fuentes
de polisacáridos que habrán de metabolizarse en la célula:
1) el glucógeno y el almidón provenientes de la alimentación
2)
el movimiento de las reservas del propio organismo.
Almidón: Principal polisacáridos de almacenaje vegetal. Consta de dos polímeros, amilosa
y amilopectina. Amilosa-‐polisacárido lineal de moléculas
de glucosa unidas por enlaces glucosídicos α(1-‐4). Amilopectina-‐polisacárido
ramificado de moléculas de glucosa unidas por enlaces glucosídicos α(1-‐4) con ramificaciones α(1-‐6) cada 10-‐20
residuos.
Glucógeno: Principal polisacáridos de almacenaje animal. Consta de un polímero ramificado de moléculas de glucosa
unidas por enlaces glucosídicos α(1-‐4) con ramificaciones
α(1-‐6) cada
8-‐10 residuos.
La movilización de estos polisacáridos implica la degradación secuencial de la macromolécula
en los monosacáridos correspondientes desde los extremos no reductores en adelante.
Existen dos mecanismos de movilización de estos azúcares:
1)
la hidrólisis
2)
la fosforólisis
Ambos procesos son químicamente
similares
aunque
cada
uno
está
adaptada
a
unas
necesidades y estrategias metabólicas concretas.
Si está cargada la molécula no se puede meter dentro de la célula. Por
eso se utiliza la hidrólisis para la digestión de polisacáridos de la dieta. Se
utiliza la fosforolisis para mecanismos intracelulares, ya que no salen de la
célula.
La fosforólisis está catalizada por enzimas de tipo fosforilasas y poseen
la gran ventaja de que generan
intermedios
que
pueden
dirigirse
directamente a la glucólisis sin mayor consumo de ATP. Por
tanto, la fosforólisis es la estrategia adecuada para la movilización de los azúcares almacenados intracelularmente.
El mecanismo hidrolítico es empleado
para
la
asimilación
en
el
intestino
de
estos
polisacáridos que son ingeridos por medio de la
dieta.
Los productos de la digestión
han de ser absorbidos por el intestino,
a través de las células
epiteliales. Puesto que los azúcares cargados e intermediarios
de la
glucólisis no pueden ser
absorbidos a través de las membranas celulares, se debe generar un
monosacárido de carga eléctrica neutra.
1) Digestión
de los polisacáridos:
Las plantas no llevan a cabo
digestión
puesto
que
éstas
son
capaces
de
generar
los
monosacáridos a través de los
procesos de fotosíntesis.
La α-‐amilasa salival digiere los enlaces α(1-‐4) del almidón
y del glucógeno.
En el intestino, la α-‐amilasa pancreática prosigue con la digestión
de los enlaces α(1-‐4) para generar maltosa y glucosa. La digestión de la amilosa se completa.
La amilopectina y el
glucógeno sólo se digieren parcialmente debido a que no se rompen los enlaces α(1-‐6). Se genera lo que se conoce
como dextrina límite.
* Las amilasas cortan desde los extremos no
reductores, pero no con especificidad de monosacárido tras monosacárido.
La digestión la
completa la enzima α(1-‐6)-‐ glucosidasa (o isomaltasa), terminan de cortar
las ramificaciones que las amilasas no pueden. Se genera maltosa y glucosa.
2) Movilización de los
polisacáridos:
En los animales
las reservas de glucógeno se encuentran en el hígado (lo sintetiza él y lo utilizan
otros), sobretodo, y en el tejido muscular esquelético (lo sintetiza él y lo utiliza él).
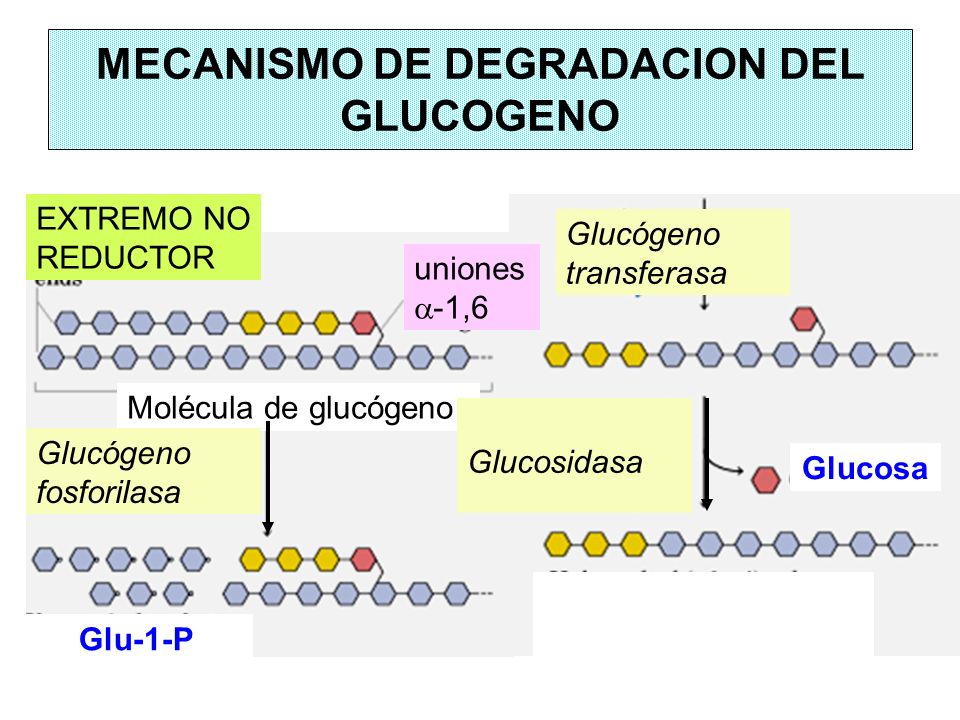
La acción de la glucógeno fosforilasa permite la liberación secuencial de las unidades
de glucosa desde los extremos no reductores (mediante una fosforílisis).
La glucógeno fosforilasa carece
de
actividad
desramificante. Su acción se detiene a 4
residuos de un extremo ramificado.
La (α1,4- α1,4) glucantransferasa es la enzima encargada de “resolver” la ramificación en un proceso de dos pasos secuenciales. La enzima posee 1) una actividad transferasa y 2) una actividad α(1-‐6)-‐glucosidasa. Actúa de manera secuencial
Por la actividad transferasa, corta e hidroliza el enlace glucosídico alfa
1-4 entre la primera glucosa 1-P y la segunda de la ramificación y se lo lleva
a otro por un enlace glucosídico alfa1-4. Entonces entra la segunda actividad
de la enzima que rompe el enlace 1-6 de la glucosa 1-P que estaba sola y se
libera así una glucosa.
Finalmente, la glucosa-1-P se transforma en
glucosa-6-P por medio de la acción de la fosfoglucomutasa.
El hígado es el principal sensor de los niveles
de glucosa endógenos en el organismo u posee las mayores reservas de glucosa en
forma de glucógeno en todo el organismo. Cuando otros tejidos requieren el
aporte de glucosa, el hígado se encarga de proporcionar dicho aporte a través
de la movilización del glucógeno o de la síntesis de glucosa a través de la
gluconeogénesis.
La glucosa-6-P generada en la movilización del
glucógeno hepático o en la gluconeogénesis hepática requiere de la eliminación
de su grupo fosfato para poder atravesar la membrana plasmática. Este proceso
está catalizado por la glucosa-6-fosfatasa.
No existe glucosa-6-fosfatasa en el músculo
esquelético, por ejemplo. El músculo no la necesita dado que él la utiliza por
lo que no lo envía a otro lugar. Además el músculo no hace gluconeogénesis.
3) Regulación de la degradación del
glucógeno en el tejido muscular esquelético.
Existe un nivel de regulación hormonal y uno
no hormonal.
El nivel de regulación hormonal se
produce a través de cascada de señales cuyo objetivo último es el control de la
actividad de la glucógeno fosforilasa.
La glucógeno fosforilasa muscular se
encuentra en forma de dímero.
La forma activa (fosforilasa a) se
genera a partir de una fosforilación de la forma relativamente inactiva
(fosforilasa b). Así, la activación completa de la enzima es llevada a cabo por
una fosforilasa b quinasa.
La desactivación la lleva a cabo una
fosforilasa fosfatasa. La activación de la fosforilasa b quinasa se produce, a
su vez, por una fosforilación que lleva a cabo la proteína quinasa A. Esta
enzima tetramérica posee 2 subunidades reguladoras y 2 subunidades catalíticas.
La forma inactiva permanente en forma
de tetrámero (R2C2). La activación por cAMP conduce a la liberación de las
subunidades catalíticas en forma de monómeros (C).
Hay una forma relajada (T) y otra tensa activa y
estos dos controles llevan desplazar el equilibrio de una forma a otra.
Fosforilasa B quinasa que está inactiva y cuando
se fosforila por medio de la pK activa, se activa.
Cuando la fosforilasa b quinasa que fosforila a
la glucógeno fosforilasa b y la pasa a glucógeno fosforilasa a.
En el mismo hepatocito se está haciendo
gluconeogénesis y generando glucosa y a la vez se está aprovechando esta
glucosa
Existe una profunda
interrelación entre estructura enzimática, control alostérico y regulación
hormonal.
·
La
misión fisiológica del control alostérico de la glucógeno
fosforilasa es activar/desactivar la degradación del glucógeno en condiciones fisiológicas “normales”, cuando la carga
energética es baja.
·
La misión fisiológica del control hormonal del mismo proceso es activar de manera
rápida el proceso frente a situaciones de “peligro”, de tal forma que no haya que esperar
a que la carga energética descienda
para activar la degradación del glucógeno.
Además, la glucógeno fosforilasa es una enzima multimérica entre cuyas subunidades se encuentra la calmodulina.
La
calmodulina posee 4 lugares de unión al Ca2+ (KM 10-‐6M). La unión del Ca2+ provoca cambios conformacionales en la calmodulina que se transmiten a la glucógeno fosforilasa (que pasa
de forma b a forma a).
Por un lado, la calmodulina
promueve la contracción de la actina y la miosina, que gastan ATP. También se
une a la carbofosforilasa del músculo, tanto forma B o A y desplaza a la forma
relajada. Promueve así la energía para que se pueda contraer el músculo y la
propia contracción
No hay comentarios:
Publicar un comentario